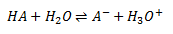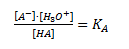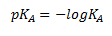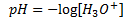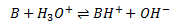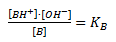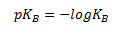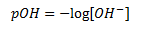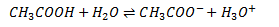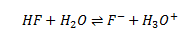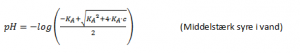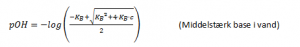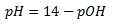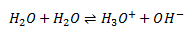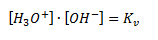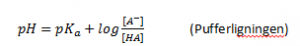I denne artikel gennemgås alt der er værd at vide om syrer og baser for medicinere (og måske dybere endnu). Vi gennemgår alle de generelle pH-formler der er værd at vide.
Der findes flere definitioner på syrer og baser og en af de mest anvendte er Brønsted-Lowrys syrebasedefinition eller Brønsteds syrebasedefinition. Man kalder også den slags syrer for Brønsted syrer og den slags baser for Brønsteds baser.
En syre defineres som et stof der kan afgive en proton (H+). For at et stof kan være en syre, skal det dels indeholde et H-atom og dels skal dette H-atom nemt kunne afgives.
En base defineres som et stof der kan optage en proton (H+). For at et stof kan være en base, skal det indeholde et lonepair.
En syrebasereaktion er en reaktion mellem en syre og en base, dvs. hvor syren afgiver en proton til en base.
Syres reaktion med vand
Når en syre reagerer med vand, overføres der en proton fra syren til vand, dvs. vand reaggerer som base.
Altså dannes der en korresponderende base A– til syren HA og en oxoniumion/hydroxoniumion/hydroniumion H3O+. Det er denne oxoniumion som er karakteristisk for en syres reaktion med vand. Ligevægtsloven for denne reaktion defineres somsyrekonstanten:
Og man kan definere en anden størrelse der kaldes for syrestyrken pKA som –log til KA. Denne størrelse angiver hvor god syren er til at reagere som syre eller med andre ord hvor god syren er til at afgive en proton.
Her gælder der følgende inddeling i pKA og hvor stærk syren er:
pKA < 0 stærk syre
0<pKA<4 middelstærk syre
4<pKA<10 svag syre
pKA>10 meget eller uhyre svag syre (kaldes ofte slet ikke for en syre)
Man kan også definere en størrelse som måler hvor meget syre der er til stede, som kaldes for pH.
Her gælder der følgende inddeling i pOH og opløsningens basiske indhold:
pH<7 sur opløsning
pH=7 neutral opløsning
pH>7 basisk opløsning
Bases reaktion med vand
Når en base reagerer med vand, overføres der en proton fra vand til basen, dvs. vand aggerer som syre.
Altså dannes der en korresponderende syre BH+ til basen B og en hydroxidion OH–. Det er denne hydroxidion som er karakteristisk for en bases reaktion med vand. Ligevægtsloven for denne reaktion defineres som basekonstanten:
Og man kan definere en anden størrelse der kaldes for basestyrken pKb som –log til KB. Denne størrelse angiver hvor god basen er til at reagere som base eller med andre ord hvor god basen er til at optage en proton.
Her gælder der følgende inddeling i pKB og hvor stærk basen er:
pKB < 0 stærk base
0<pKB<4 middelstærk base
4<pKB<10 svag base
pKB>10 meget eller uhyre svag base (kaldes ofte slet ikke for en base)
Man kan også definere en størrelse som måler hvor meget base der er til stede, som kaldes for pOH.
Her gælder der følgende inddeling i pOH og opløsningens basiske indhold:
pOH<7 basisk opløsning
pOH=7 neutral opløsning
pOH>7 sur opløsning
Sammenhæng mellem pH og pOH
Summen af pH og pOH vil altid være lig med 14:
pH + pOH = 14
Eller:
[H3O+]·[OH–] = 10-14
Stærk syres reaktion med vand
En stærk syre, f.eks. HCl, reagerer fuldstændig med vand:
HCl + H2O à Cl– + H3O+
Her kan man godt antage at startkoncentrationen af HCl c er lig med den aktuelle koncentration af H3O+ ved ligevægt. Det betyder at man beregner koncentrationen af en stærk syre ved formlen:
pH = -log(c) (pH af stærk syre i vand)
Hvor c er den formelle koncentration af HCl.
Svag syres reaktion med vand
En svag syre, f.eks. CH3COOH (eddikesyre), reagerer stort set slet ikke. Her vil der indstille sig en ligevægt:
For at finde formlen for pH af en svag syre reducerer man formlen for en middelstærk syre (der er den generelle formel) ved at sætte oxoniumionkoncentrationen i nævneren i en af mellemregningerne ved beviset af formlen lig med nul. Dette resulterer i følgende formel for pH af en svag syre:
Middelstærk syres reaktion med vand
En middelstærk syre, f.eks. HF (flussyre), reagerer middelt med vand. Her vil der også indstille sig en ligevægt.
Og der gælder følgende formel for pH:
Formel for pH af base i vand
Der er tilsvarende formler for pOH af baser i vand. Først stærk base i vand:
pOH = -log(c) (pH af stærk base i vand)
Og formlen for en svag base i vand:
Og formlen for en middelstærk base i vand:
Når man vil regne pOH om til pH benytter man herefter formlen:
Amfolytter
En amfolyt er et stof der både kan aggere som base og som en syre. Dvs. den har både en lonepair så den kan optage en proton og et syrebrint så den kan afgive en proton. Et sådant stof kan reagere med sig selv. Et eksempel er vand:
Og ligevægtsloven siger her:
Hvor Kv kaldes for vands ionprodukt og er lig med 10-14. Bemærk i øvrigt at vand selv indgår i ligevægtsloven som et 1-tal fordi det er solvent.
Det betyder også at koncentrationen af både oxoniumioner og hydroxidioner er lig med 10-7 M.
Man kalder også ovenstående reaktion mellem vand for vands autoprotolyse. Det er denne reaktion der er skyld i at alt vand, også selvom man ikke har tilført base eller syre, indeholder både base og syre i sig selv.
Pufferligningen
Hvis en syre reagerer med en base, således at man har en blanding af en syre og dens korresponderende base i samme opløsning kan man benytte Pufferligningen (eller Henderson-Hasselbach ligningen):
Titrering
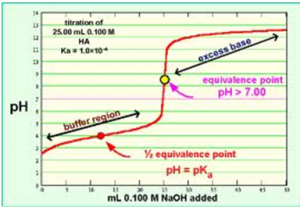
En titrering af en syre er hvor man reagerer en kendt mængde syre med ukendt koncentration med en kendt koncentration base og aflæser mængden man skal bruge for at ramme ækvivalenspunktet. Ækvivalenspunktet (ÆP) er det punkt hvor alt syren er blevet neutraliseret af basen.
Titrering af monovalent syre med stærk base
Ved titrering af en monovalent svag syre i vand skal man bruge forskellige pH-formler gennem titreringen.
pH før tilsætning af basen pH af syre i vand
pH efter tilsætning af basen, men før ÆP pufferligning
pH ved og efter ÆP pH af stærk base i vand
Bemærk at man er halvejs ved tilsætningen af base (halvdelenaf VNaOH er nået) når pH = pKa.
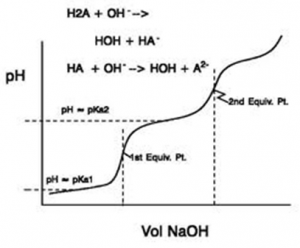
Titrering af polyvalent syre med stærk base
Ved titrering af polyvalente syrer er der et antal ÆP svarende til valensen. Således har svovlsyre 2 ÆP og phosphorsyre 3 ÆP. Igen her skal benyttes flere formler:
pH før tilsætning af base pH af syre i vand
pH efter tilsætning af base, men før ÆP1 pufferligning
pH ved ÆP1 amfolyt
pH efter ÆP1 men før ÆP2 pufferligning
pH ved og efter ÆP2 pH af stærk base i vand
Uopløselige syrer
Nogle gange arbejder man med syrer som er uopløselige eller tungtopløselige i vand. Dette betyder at det kun vil være den del der er opløst i vand som reagerer som syre – den del der er fældet ud reagerer ikke. Således fungerer benzoesyre i praksis ikke som syre, da den er tungtopløseligt i vand.
Hvorfor fungerer syrer som syrer?
Tidligere så vi at for at et stof kunne reagere som syre skulle det dels indeholde et H-atom og dels skulle dette H-atom sidde ”løst nok” til at kunne afgives i form af en proton. Men hvad er der egentlig ved de forskellige klasser af syrer der gør dem til syrer?
Generelt kan der være to årsager til at en syre kan reagere som syre. Enten er det fordi syren er ustabil eller også er det fordi den korresponderende base er stabiliseret af et eller andet fænomen.
HCl/HF/HBr/HI Både Cl, F, Br og I er meget elektronegative og det betyder at hvis en base angriber protonen, vil elektronerne i bindingen mellem Cl og H kunne føres over til Cl, fordi den er god til at tiltrække elektroner.
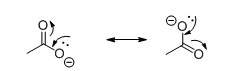
CH3COOH Eddikesyrer og andre organiske carboxylsyres syreegenskaber skyldes at dens korresponderende base er stabiliseret af resonansstrukturer:
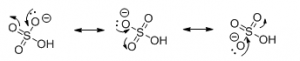
H2SO4 Svovlsyre (phosphorsyre og andre lignende syrer) har sine syreegenskaber fordi syrens korresponderende base er resonansstabiliseret.
Syrebaseindikatorer
Syrebaseindikatorer er stoffer som ved bestemte pH-værdier skifter farve. Disse er i sig selv syrer og baser som skifter farve når mere end 50% er blevet enten protolyseret eller deprotolyseret – dette sker når pH = ½pKa altså når man har nået halvdelen af deres ækvivalenspunkt.
Der findes et hav af forskellige syrebaseindikatorer som hver har deres pH-region hvor de skifter farve.
Lewis syrer og baser
En anden syrebaseteori er Lewis syrebaseteori og hvor Brønsteds syrebaseteori drejede sig om overførsler af protoner drejer Lewis syrebaseteori om overførsler af elektroner.
Således defineres en Lewis syre som et stof der kan overføre et elektronpar til et andet stof. Og en Lewis base er et stof der kan modtage et elektronpar. En Lewis syre kaldes også en nukleofil og en Lewis base kaldes også en elektrofil.
Et eksempel på en Lewis syre er AlCl3 eller BF3.
Sidst opdateret 30. maj 2023