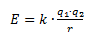I denne artikel gennemgår jeg det generelle ved kemiske bindinger. Kemisk binding sker mellem elektroner. Når man skal beskrive en kemisk binding forestiller man sig to ladninger (elektroner) som nærmer sig, laver et overlap og har den afstand der giver den mindste energi (lavest energiniveau = mest stabil).
Elektrostatisk binding
Den elektrostatiske energi en binding mellem to ladninger (f.eks. elektroner eller protoner) kan have, beskrives ved formlen:
Hvor:
E er den elektrostatiske energi
q1 og q2 er ladningen af hver af de to ladninger
r er afstanden mellem de to ladninger
k er en konstant lig med 9·109 Nm2/C2
Kovalent binding
Ved en kovalent binding sker der et kompromi mellem de tiltrækningskræfter der virker mellem elektroner og protoner samt de frastødningskræfter der sker mellem henholdsvis elektroner eller protoner. Den optimale bindingslængde i et molekyle er altså en balance/et kompromi mellem de tiltræknings- og frastødningskræfter der sker mellem ladningerne.
Hydrogenmolekylet H2
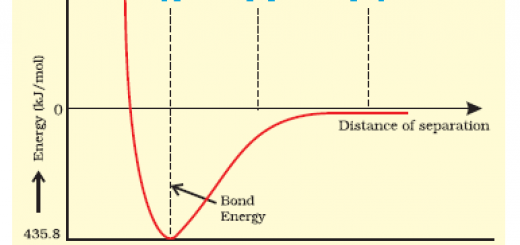
Ofte når man skal forstå bindinger og molekyler vælges H2 da denne består af to hydrogenatomer der hver har én elektron og én proton og er det mest simple molekyle. Der vil under dannelse af H2 være både frastødningskræfter mellem de to elektroner, frastødningskræfter mellem de to protoner, tiltrækningskræfter mellem den ene elektron og det andet proton samt tiltrækningskræfter mellem den anden elektron og det første proton. Man skal forestille sig at man tager de to hydrogenatomer og lader dem nærme sig hinanden. Jo tættere på de kommer,jo stærkere bliver både tiltrækningskræfterne og frastødningskræfterne, jf. lov om elektrostatisk energi. Den optimale bindingslængde er den r-værdi hvor tiltrækningskræfterne og frastødningskræfterne bliver lige store.
På ovenstående graf tegnes den potentielle energi for et hydrogenmolekyle som funktion af afstanden mellem de to atomkerner. Den mest stabile struktur er ved minimumspunktet – her kan man aflæse både bindingsenergien og bindingslængden.
En anden karakteristik af denne binding i hydrogenmolekylet er, at selvom man roterer atomerne omkring bindingen, ændrer man ikke på den potentielle energi – med andre ord bliver molekylet ikke mindre stabil ved at rotere. En binding med disse egenskaber kaldes for en σ-kovalent binding.
Polær kovalent binding
Hvis atomerne i en binding har forskellige elektronegativitet, vil der ske en forskydning i elektronfordelingen, så den ikke længere er symmetrisk fordelt mellem de to atomer. Det atom der har den højeste elektronegativitet vil få den største elektronfordeling og dermed blive partielt negativt ladet δ- og det andet atom vil blive partielt positivt ladet δ+. Dette kaldes for en polær kovalent binding.
Ionbinding
En binding mellem de atomer der har en meget stor forskel i elektronegativitet (f.eks. mellem metaller og ikke-metaller) dannes en ionbinding. I en ionbinding vil, ideelt set, det atom der er mest elektronegativt ikke være partielt negativt ladet, men fuldstændig negativt ladet og omvendt for det atom der er mindst elektronegativitet. Således sker der en fuldstændig ladningsadskillelse af elektronmassen som bindingen består af mellem de to atomer. Denne fuldstændige ladningsadskillelse gør at de to atomer tiltrækker hinanden.
Igen kan man for ionbindinger anvende loven om elektrostatisk energi, hvor ladningerne svarer til elektronens ladning:
Hvor:
E er den elektrostatiske energi
q1 er ladningen af den ene elektron = 1,6·10-19 C
q2 er ladningen af den ene elektron = -1,6·10-19 C
r er afstanden mellem de to ladninger
k er en konstant lig med 9·109 Nm2/C2
Ioner er, i fast form, sat op i et såkaldt ordnet iongitter. Dette gitter kan brydes hvis man tilfører energi og denne energi kaldes for gitterenergien eller lattice energien.
Lewis strukturer
En tegning af hvordan bindingerne i et molekyle er opbygget samt hvilke elektroner der er bindende og hvilke der er ikke-bindindende kaldes for en lewis struktur. Lewis strukturer:
- Hver atom repræsenteres med et grundstof symbol
- Kun valenselektroner kan ses i en lewis struktur
- En linje der forbinder to atomer repræsenterer 2 elektroner (enkeltbinding). En dobbeltlinje repræsenterer 4 elektroner (dobbeltbinding). En trippellinje repræsenterer 6 elektroner (trippelbinding).
- Prikker der er sat ved siden af et atom repræsenterer ikke-bindende elektroner.
Lewis strukturer optegnes efter følgende fremgangsmåde:
- Optæl valenselektroner. Hvis det er en ion, tilføjes 1 elektron for hver negativ ladning eller træk 1 elektron fra for hver positiv ladning.
- Tildel bindingsnetværket ved enkeltbindinger. Det mindst elektronegative atom skrives centralt, de resterende skrives yderst.
- Placer 3 ikke-bindende elektronpar på hver ydre atom (undtagen for H). Alle ydre atomer, pånær H, skal have 8 elektroner (oktetreglen).
- Tildel de resterende valenselektroner til det indre atom.
- Minimer den formelle ladning på alle atomer. Den formelle ladning for et atom er givet ved forskellen mellem antallet af valenselektroner i det frie atom og antal elektroner tildelt atomet i lewis strukturen. Man minimerer den formelle ladning ved at ændre på elektronfordelingen.
Bemærk: en lewis struktur viser ikke den tredimensionelle struktur for et molekyle – den viser hvordan valenselektronerne er fordelt i molekylet.
Resonansstrukturer
Oft e er flere lewis strukturer muligt at tegne op hvor den formelle ladning bliver minimeret – disse strukturer kaldes for resonansstrukturer.
Valence skal elektron par frastødning (VSEPR-modellen)
VSEPR-modellen tager, i modsætning til modellen med lewis strukturer, også hensyn til den tredimensionelle struktur for molekylet idet man minimerer frastødningen mellem elektroner. Det betyder at elektronparene omkring et indre atom skal sidde så langt fra hinanden som muligt.
VSEPR strukturen bestemmes på følgende måde:
- Tegn Lewis strukturen for molekylet.
- Tæl antal bindende elektronpar og lone pairs omkring det indre atom og benyt nedenstående tabel til at bestemme den optimale geometri for molekylet. VSEPR tager ikke hensyn til forskellen mellem enkelt-, dobbelt- eller trippelbindinger – disse behandles ens.
- Modificer geometrien, hvis nødvendigt, så der tages hensyn til at nogle elektronpar frastøder hinanden mere end andre. Lone-pairs frastøder hinanden mest, herefter frastødningen mellem lonepair og bindende par og til slut frastødningen mellem bindende par. LP-LP > BP-LP > BP-BP.
| Antal elektronpar | Geometri |
| 2 | Lineær |
| 3 | Trigonalt plant |
| 4 | Tetrahedralt |
| 5 | Trigonal bipyramidalt |
| 6 | Oktahedralt |
Dipolmomenter
Polære bindinger er bindinger hvor det ene atom er en smule negativ og det andet er en smule positiv, man siger også at molekylet har et dipolmoment. Størrelsen på dipolmomentet afhænger direkte af elektronegativiteten, således at en stor elektronegativitetsforskel giver et større dipolmoment.
Desuden afhænger dipolmomentet også at molekylets form. Alle 2-atomige molekyler der består af 2 forskellige atomer (f.eks. HF, HCl…) har et dipolmoment. Ved mere komplekse molekyler skal geometrien tages højde for. Hvis man har et molekyle der har et dipolmoment for en individuel binding, men molekylets geometri gør at dipolmomenterne bliver ophævet, vil molekylet samlet set IKKE have et dipolmoment.
Et eksempel er CO2 der er et 3-atomig lineært molekyle. Hver C-O-binding har et dipolmoment, således at O-atomerne er partielt negativt ladet og C-atomet er partielt positivt ladet. Men geometrien af molekylet gør at det negative tyngdepunkt i molekylet lander midt i C-atomet sammen med det positive tyngdepunkt og således ophæves dipolmomentet.
Bindingslængde
Bindingslængden for et molekyle er den mest stabile afstand mellem atomerne.
Generelt gælder der:
- Jo større atomradius (større atomer), desto større bindingslængder.
- Jo større dipolmoment for bindingen, desto mindre bindingslængder (større tiltrækning).
- Jo større elektronegativitetsforskel, desto mindre bindingslængder (større tiltrækning).
- Jo flere elektroner i en binding, desto kortere bindingslængde.
Bindingsenergi
Bindingsenergien er den mængde energi der skal til for at bryde en bestemt binding.
Der gælder generelt følgende:
- Jo flere elektroner der deles mellem atomer (resonansstrukturer), desto større bindingsenergi.
- Jo større elektronegativitetsforskel, desto større bindingsenergi.
- Jo større bindingslængde, desto mindre bindingsenergi.
Sidst opdateret 30. maj 2023