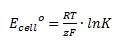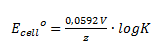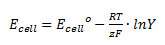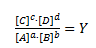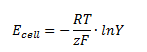Dette er nogle generelle noter til elektrokemi. Du er meget velkommen til at komme med rettelser eller spørgsmål nederst.
Oxidation og reduktion
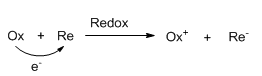
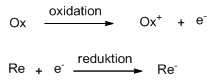
En oxidation af et stof er en reaktion hvor stoffet går op i oxidationstrin – eller at stoffet afgiver elektroner. En reduktion af et stof er en reaktion hvor stoffet går ned i oxidationstrin – eller at stoffet modtager elektroner.
Hvis et stof bliver oxideret, vil der altid være et stof der bliver reduceret, idet det stof der bliver oxideret har afgivet sine elektroner til det stof der bliver reduceret. Man siger der er sket en redoxproces (en reduktionsoxidationsproces).
Et stof der selv bliver oxideret, har en reducerende virkning og er derfor et reducerende stof. Et stof der selv bliver reduceret, har en oxiderende virkning og er derfor et oxiderende stof.
Hvor Ox er det stof der bliver oxideret (=reduktionsmiddel) og Re er det stof som bliver reduceret (=oxidationsmiddel).
Man kan også opstille nogle halvreaktioner (halvcellereaktioner) for denne reaktion.
Oxidationstrin
Oxidationstrinnet, er den ladning et atom i et molekyle ville have hvis det delte elektronpar i hver kovalent binding udelukkende var tildelt det elektronegative atom i molekylet. Derfor er oxidationstrinnet den ladning hver atom ville have hvis molekyet blev delt op i enatomige ioner.
Summen af oxidationstrin for hvert atom i et molekyle svarer overens med den samlede ladning for molekylet.
Man tildeler oxidationstrin fir et atom i et bestemt molekyle efter følgende regler:
- Oxidationstrinnet for ethvert frit, neutral grundstof (et grundstof der ikke er kombineret kemisk med et andet grundstof) er lig med nul.
- Oxidationstrinnet for enhver simpel monoatomig ion er lig med atomets ladning.
- Summen af alle oxidationstrin af atomerne i et neutralt molekyle må være lig med nul. Og summen af oxidationstrin for hvert atom i et molekyle svarer overens med den samlede ladning for molekylet.
- I alle molekyler har F oxidationstrin -1.
- I næsten alle molekyler har H et oxidationstrin på +1.
- I næsten alle molekyler har O et oxidationstrin på -2.
Oxidationstrin skrives enten som et + eller – og så et romertal der svarer overens med oxidationstrinnet. Man kan også skrive det som et + eller – og så et tal der svarer overens med oxidationstrinnet. Dette adskiller sig fra måden man skriver almindelige ladninger på hvor man først skrive ladningstallet og herefter et + eller -.
Hvis et atom kan have flere oxidationstrin, skriver man det i parentes og romertal efter grundstoffets navn i navnet for molekylet. F.eks. kan man jernoxid både skrives som Jern(II)oxid FeO som har oxidationstrin +II for jern, samt Jern(III)oxid Fe2O3 som har oxidationstrin +III for jern. Grunden til at der findes flere forskellige slags for jern er netop at den både findes i en form hvor den oxidationstrin +II og en form hvor den har oxidationstrin +III.
Der findes molekyler der ikke overholder ovenstående regler for tildeling af oxidationstrin, f.eks. H2O2 hvor O har oxidationstrin –I eller NaH hvor H har oxidationstrin -1.
Afstem redoxreaktioner
Når man skal afstemme en redoxreaktion kan man gøre det på nedenstående måde. Disse regler kan dog kun finde sted i en redoxreaktion hvor et type atom, f.eks. O, kun indgår i enten oxidationsmidlet eller reduktionsmidlet – hvis det indgår i begge to kan det være vanskelig at gennemføre det på denne måde, da O i såfald både kan gå op i oxidationstrin og ned igen.
- Opskriv oxidationstrin for samtlige atomer i alle molekyler i reaktionsligningen.
- Find ud af hvilket stof der er oxidationsmiddel (går ned i oxidationstrin) og hvilket der er reduktionsmiddel (går op i oxidationstrin).
- Tildel størrelserne SSX (samlet stigning i oxidationstrin for reduktionsmiddel) og SFY (samlet fald i oxidationstrin for oxidationsmiddel).
- SSx = SFY skal være gældende for at ligningen er afstemt. Få dem til at blive lige store ved at gange faktorer foran dem og skrive dem på reaktionsskemaet.
- Tildel størrelserne l.v. (samlet ladning på venstresiden) og l.h. (samlet ladning på højresiden).
- l.v. = l.h. for at ligningen er afstemt. Få dem til at blive lige store ved enten at tilføre et passende antal H+ på venstresiden i surt miljø, ellertilføre et passende antal OH– i basisk miljø på højresiden.
- Tildel størrelserne A.vO (Antal O-atomer på venstresiden) og A.hO (Antal O-atomer på højresiden).
- A.vO = A.hO for at reaktionen er afstemt. Få dem til at passe ved at tilføre enten vand på højre eller venstresiden.
- Kontroller ligningen ved at se om A.vH = A.hH (Antal H-atomer på venste- eller højresiden).
Hvis man har været igennem dette skema skulle ligningen være afstemt.
Galvaniske celler
Galvaniske celler er et system bestående af to halvceller, dvs. delsystemer hvori der foregår en halvcellereaktion. Med andre ord er galvaniske celler systemer hvori der foregår en redoxreaktion.
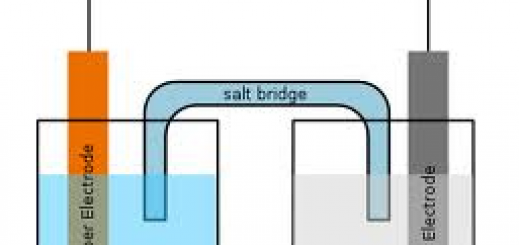
En galvanisk celle består af to halvceller med hver sin elektrode i. De to halvceller er forbundet med en saltbro og potentialforskellen (Eller den elektromotoriske kraft = emf) måles ved hjælp af et forbundet voltmeter. Ved den ene elektrode foregår der oxidation og ved den anden foregår der en reduktion. Hver elektrode er dyppet ned i hver sin opløsning bestående af et salt hvori elektrodekomponentet indgår.
Et eksempel på en galvanisk celle er nedenunder hvor der er en Cu-elektrode dyppet i CuSO4 og en Zn-elektrode dyppet i ZnSO4. Mellem de to elektroder er der en saltbro og et voltmeter forbinder de to elektroder og måler potentialforskellen.
Ved Cu-elektroden vil der ske det at Cu2+ vil vandre ud i CuSO4-opløsningen, idet Cu-elektroden bliver oxideret. Denne oxidation vil efterlade elektroner på elektroden. Dette vil gøre Cu-elektroden mere negativ og opløsningen lige omkring elektroden positiv og dette vil få Cu2+-ioner til at vandre væk fra elektroden og SO42--ioner til at vandre hen mod elektroden.
Ved Zn-elektroden vil der ske det at Zn2+ vil vandre fra ZnSO4-opløsningen og hen mod elektroden hvor det vil sætte sig som fast Zn, idet der tages elektroner fra elektroden. Dette vil gøre Zn-elektroden mere positiv og opløsningen lige omkring elektroden negativ, hvilket vil få flere Zn2+-ioner til at vandre hen mod elektroden og flere SO42--ioner til at vande væk fra elektroden.
Da der ved Cu-elektroden er sket det at Cu à Cu2+ + 2e–, så er der her sket en oxidation og denne elektrode er derfor anoden. Ved Zn-elektroden er der sket det at Zn2+ + 2e– à Zn og der her altså sket en reduktion og denne elektrode er derfor katoden. Med andre ord er venstre elektrode anoden og højre elektrode er katoden – dette er ofte den konvention man anvender når man opstiller en galvanisk celle.
Da der blev efterladt elektroner på Cu-elektroden var denne anode og negativt ladet. Da der blev taget elektroner fra Zn-elektroden var denne katode og positivt ladet. Transporten af elektroner (ladning) sker ved hjælp af ioner.
En saltbro tillader transport af ioner mellem de to halvceller, således at ioner kan vandre fra den ene opløsning til den anden opløsning. Ionerne bringer ladning med sig og udligner dermed den ladning der er bygget op i elektroderne.
Opskrivning af galvaniske celler og celle diagrammer
Der findes en helt bestemt konvention når man skal opskrive galvaniske celler og celle diagrammer. Man opskriver hvordan en galvanisk celle er opbygget ved hjælp af et celle diagram:
A(s) | An+ (aq) || Kn+ (aq) | K(s)
Hvor A er anoden og K er katoden. Med andre ord opskriver man altid anoden til venstre og katoden til venstre. En | angiver faseskiftet (mellem fast elektrode og flydende opløsning) og || angiver en saltbro mellem de to halvceller. Hvis der er to ioner i en opløsning i samme fase, skrives de med et komma imellem.
I et sådan cellediagram antages det altid at reduktion foregår på højresiden og oxidation foregår på venstresiden. Man vil derfor få følgende halvcellereaktioner og cellereaktioner:
A(s) -> An+ (aq) + ne–
Kn+ (aq) + ne– -> K (s)
A(s) + Kn+ (aq) -> An+ (aq) + K(s)
Denne reaktion vil enten være spontan eller ikke-spontan. Den er spontan hvis vores antagelse om at reduktion foregår på højresiden og oxidation på venstresiden er korrekt. Er den ikke korrekt er det reaktionen mod venstre der er spontan.
Nogle gange vil der også være en inert Pt-elektrode hvor der kan foregå oxidation eller reduktion. Dette er især hvis man anvender en gasart som elektrode eller en ion.
Reduktionspotentialer og elektromotorisk kraft
Den maksimale potentialforskel en galvanisk celle kan generere kaldes for cellens cellepotentiale (Ecelle) eller elektromotorisk kraft (emf). Der gælder:
Ecell = ER – EL
Hvor Ecell er den elektromotorisk kraft, ER er potentialet for højre elektrode og EL er potentialet for venstre elektrode. Hvor stor Ecell kan blive afhænger af opbygningen af den galvaniske celle og hvad den består af. Herudover afhænger den af koncentrationerne af ionerne i hver halvcelle og temperaturen.
Skal man sammenligne forskellige celler anvendes standardcellepotentialet Ecello, hvor alle ionkoncentrationer er lig med 1 M og allegassers gastryk er lig med 1 bar. Temperaturen er som regel 25oC men dette er ikke en del af standardbetingelserne, så denne bør man altid angive.
Ecello = ERo – ELo
Fortegnet for Ecello afhænger af polariteten af elektroderne. Hvis der foregår reduktion på højre elektrode og oxidation på venstre elektrode (som antaget ved cellediagrammer) vil Ecello være positiv. Omvendt vil den være negativ.
Det betyder at hvis man opskriver et cellediagram og finder cellereaktionen, vil denne være spontan hvis Ecello > 0 og ikke-spontan hvis Ecello < 0.
Et standardreduktionspotentiale for en elektrode, svarer til standardcellepotentialet der er målt for en galvanisk celle med elektroden som den højre elektrode og en Pt|H2-elektrode som den venstre elektrode (brintelektroden er en referenceelektrode hvor standardreduktionspotentialet er sat lig med 0 mV). Ved brintelektroden foregår der følgende halvcellereaktion:
2 H+ (aq, 1 M) + 2 e– -> H2 (g, 1 bar)
Når man forbinder to forskellige elektroder i en galvanisk celle, vil den elektrode der har det største standardreduktionspotentiale være højre elektrode og dermed den elektrode hvor der foregår reduktion, mens den elektrode med det mindste standardreduktionspotentiale vil være venstre elektrode og dermed den elektrode hvor der foregår oxidation.
Man kan slå disse standardreduktionspotentialer op i tabeller og dermed opstille et cellediagram for en galvanisk celle udfra dette, således at man får den spontane reaktion som cellereaktion. Herefter kan man beregne cellens standardcellepotentiale ved formlen:
Ecello = ERo – ELo
Hvor ERo og ELo er standardreduktionspotentialet for henholdsvis højre og venstre elektrode.
Husk: I en tabel med standardreduktionspotentialer, vil de elektroder der har den største værdi være nemmest at reducere og de elektroder der har den laveste (negative) værdi vil være nemmest at oxidere.
Andre referenceelektroder
Man kan også anvende andre referenceelektroder såsom en mættet calomel elektrode (SCE-elektrode) der består af kviksølv(I)chlorid og calomel (Hg2Cl2) i en mættet KCl-opløsning. Her vil der ske følgende reaktion:
Hg2Cl2 (s) + 2 e– -> 2 Hg (l) + 2 Cl– (aq)
Og denne har et standardreduktionspotentiale på 0,244 mV ved 25oC set i forhold til hydrogen som referenceelektrode.
Oxiderende syrer
Nogle syrer kan oxidere nogle metaller, dvs. alle de elektroder som har et negativ standardreduktionspotentiale. Alle dem der har et højere standardreduktionspotentiale kan de ikke oxidere.
Andre syrer er bedre til at oxidere, fordi de har en meget oxiderende korresponderende base. Så kan de ofte også oxidere nogle af de elektroder der har en positiv standardreduktionspotentiale.
Men det er ikke alle syrer der kan fungere som oxidationsmiddel for disse elektroder. Alle syrer, hvis den korresponderende base er et dårligere oxidationsmiddel end H+ (og dermed sværere at reducere i forhold til H+) forventes ikke at kunne fungere som oxidationsmiddel og kaldes derfor for nonoxiderende syrer. Alle de resterende syrer kaldes for oxiderende syrer.Eksempler på oxiderende syrer er HNO3 og konc., varm H2SO4, eksempler på nonoxiderende syrer er HCl, H3PO4, organiske syrer og kold, fortyndet H2SO4.
Med andre ord kan oxiderende syrer oxidere alle elektroder med negativ standardreduktionspotentiale og evt. nogle med positiv standardreduktionspotentiale. Nonoxiderende syrer kan kun oxidere elektroder med negativ standardreduktionspotentialer.
Cellepotentialer og gibbs fri energi ændring
Ændringen i Gibbs fri energi for et system er det maksimale arbejde man kan få ud af systemet. Cellepotentialet for en galvanisk celle var også det maksimale potentiale man kunne opnå med cellen. Der gælder følgende sammenhæng:
ΔG=-zFEcell
Hvor z er antal mol elektroner der overføres i systemet (angives også ofte som et n), F er faradays konstant = 96485 C/mol, Ecell er cellens potentiale og ΔG er ændringen i Gibbs fri energi for systemet. Af denne ligning kan man også fortolke at hvis Ecell er positiv, vil ΔG være negativ og reaktionen vil være spontan og omvendt.
Cellepotentialer og ligevægtskonstanten
Man kan beregne cellepotentialet udfra ligevægtskonstanten på følgende måde:
Hvor Ecello erstandardcellepotentialet, R er gaskonstanten, T er temperaturen i K, z er antal elektroner der overføres, F er faradays konstant (=96485 C/mol) og K er ligevægtskonstanten.
Man kan også omskrive denne til en formel hvori der indgår log i stedet for ln:
Bemærk at der her kun beregnes standardcellepotentialet og at det kun gælder hvis alle opløste stoffer har en koncentration på 1 M og alle gasser har et partialtryk på 1 bar – ellers skal man anvende nernsts ligning nedenunder.
Nernsts ligning
Hvis ikke alle opløste stoffer har en koncentration på 1 M og alle gasser har et partialtryk på 1 bar, skal man anvende Nernsts ligning når man skal finde cellepotentialet udfra ligevægtskonstanten. Nernsts ligning ser således ud:
Hvor Ecell er cellepotentialet, Ecell er standardpotentialet, R er gaskonstanten, T er temperaturen i K, z er antal elektroner der overføres, F er faraday konstanten (=96485 C/mol) og Y er reaktionsbrøken.
Hvor reaktionsbrøken Y er givet ved:
Koncentrationsceller
Man kan også konstruere elektrokemiske celler hvor elektroderne er den samme, men hvor koncentrationerne af elektrolytterne i opløsningerne hvor elektroderne er dyppet i er forskellige. Dette kaldes for koncentrationsceller. Forskel i koncentrationerne vil også give en elektromotorisk kraft der kan opnås i cellen.
Igen kan man anvende Nernsts ligning for disse celler, men standardpotentialet vil her være lig med 0 (da det er samme elektroder).
Elektrolyse
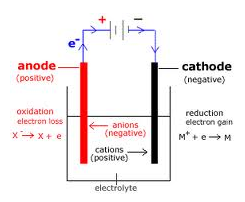
Ved en elektrolytisk celle sætter man en strømforsyning til en celle hvor der i samme opløsning er begge elektroder og derved kan man tvinge en ekstra spænding på eller vende spændingen.
Den elektrode hvor man sætter den positive pol fra strømforsyningen til, vil der trækkes elektroner ud af elektroden, derved vil oxidation foregå og således er elektroden en anode. Der hvor man sætter den negative pol fra strømforsyningen til, vil der puttes elektroner ind i elektroden, derved vil reduktion foregå og således er den elektrode en katode.
Anionerne i opløsningen vandrer hen mod anoden og kationerne vandrer hen mod katoden.
Forskel mellem elektrolytisk celle og galvanisk celle
I en elektrolytisk celle er katoden negativ (der foregår reduktion) og anoden er positiv (der foregår oxidation), hvor i en galvanisk celle er katoden positiv (reduktion foregår) og anoden er negativ (oxidation foregår).
Sidst opdateret 30. maj 2023