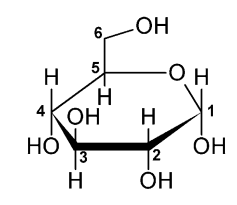
Glukose er et af de mest simple kulhydrater og grundstenen i mange kulhydrater i kroppen. Glukose findes i en alfa- og betaform afhængig af hvad vej OH vender på position 1.
Glucose og insulin
Når [glukose] i blodet stiger øges gennemstrømningen af glukose i glykolysen i β-cellerne i pancreas. Dels fordi disse celler har GLUT2, der udligner [glukose] i blod og celle når dette er højt, dels fordi disse celler har isoformen glukokinase af hexokinasen, der ikke hæmmes af glucose-6-phosphat (G6P) (begge dele som i lever celler). Dette vil gøre, at [ATP] i cellen stiger, hvilket vil hæmme efflux fra K+ kanalerne i plasmamembranen via ATP-gatede K+ kanaler. Dette vil skabe en depolarisering, der aktiverer spændingsafhængige calcium kanaler, hvorfor calcium vil strømme ind. Ca2+ virker som mediator af vesikel fusion med PM gennem konformationel ændring i SNARE proteiner på overfladen af vesikler hvorved insulin holdige vesikler exocyteres og insulin frigives til blodet.
Insulin signalering kan i diabetikere behandles med sulfonylurea som er et stof der binder til den ATP-gated K+ kanal hvorved denne lukkes, dette medfører en depolarisering af membranen uden tilstedeværelse af ATP. Dette er en brugbar metode til at aktivere insulin sekretion, hvis β-cellerne er mindre responsive overfor stigende glucose koncentrationer.
Regulering af glykogen i musklerne
I musklerne skal glykolysen være aktiv, når der er brug for energi. Glykolysen har tre regulative punkter: hexokinasen, PFK-1 og pyruvate kinasen.
I musklerne hæmmes hexokinasen allosterisk af sit produkt G6P. G6P vil stige, når F6P stiger, da disse er i ligevægt. Derfor hæmmes hexokinasen, når PFK-1 er hæmmet ved højt energi-niveau eller FA-forbrænding.
PFK-1 aktiveres allosterisk af AMP/ADP og hæmmes allosterisk af ATP, H+, P-creatin samt citrat. Lavt energi-niveau aktiverer, mens højt hæmmer. Derudover hæmmer citrat, da dette er tegn på nedbrydning af FA, der er tegn på faste (glukose-FA cyklus).
Pyruvat kinasen aktiveres af cAMP, F1,6BP (positiv feed forward) og hæmmes af ATP, lange FA, acetyl CoA og alanin, som signalerer at der højt energiniveau og at der er nok energi substrater tilstede i form af FA og AA. cAMP aktiverer, da denne second messenger også er en del af pathwayen for PKA, der jo aktiveres af adrenalin i musklerne. Pyruvate kinasen er ikke direkte hormonelt reguleret som det ses i leveren, hvor den deaktiveres af PKA phosphoryleringer, i stedet er den aktiveret gennem øget frigivelse af substrat for glykolyse gennem aktivering af glykogenolyse.
I muskler har PKA den omvende effekt på glykolyse af hvad der ses i lever idet PKA øger glykolyse gennem aktivering af glykogenolyse gennem aktiverende phosphoryleringer af GPK. Husk at muskler ikke har glukoneogenese som leveren. Derimod aktiveres glukoneogenesen af PKA i leveren, som respons på faste.
Acetyl CoA og FA hæmmer som en del af glukose-fedtsyre cyklus glykolysen, så man ikke spilder kostbar glukose, når [FA] er høj, hvilket jo er tegn på faste i kroppen.
Regulering af glykogen i leveren
Ligesom i musklerne har glykolysen tre regulative punkter: hexokinasen, PFK-1 og Pyruvat kinasen.
I leveren hæmmes glukokinasen IKKE allosterisk af sit produkt G6P (som i musklerne), men af et regulatorisk protein, der binder enzymet og trækker det ind i nukleus når [F6P] er høj og frigiver det igen når [glukose] er høj. G6P kan i leveren gå flere veje, og det er vigtigt at kunne fylde glykogenlagret op, når der er højt blodsukker. Derfor er første regulative skridt i glykolysen nærmere PFK-1.
PFK-1 aktiveres allosterisk af AMP/ADP og hæmmes allosterisk af ATP samt citrat. Derudover findes hele systemet med det bifunktionelle enzym, der danner F2,6BP, når det er dephosphoryleret (via insulin) og nedbryder F2,6BP igen, når det er phosphoryleret (via glukagon). PFK2 aktivitet er i leveren reguleret af en inhibitorisk phosphorylering af PKA, denne phosphorylering fjernes af PP2A som aktiveres af insulin. Dette er smart for at undgå spildte cykler, så glykolysen og glukoneogenesen ikke er aktive samtidigt. Dette reguleres hormonelt af insulin og glukagon, der jo signalerer henholdsvis fødeindtag og faste i kroppen.
Pyruvat kinasen aktiveres af F1,6BP (feed forward) og hæmmes af ATP, lange FA, acetyl CoA, alanin og cAMP. Derudover kan enzymet også fosforyleres og deaktiveres af PKA via glukagon og dermed hæmmes, altså hæmmes pyruvate kinase af stigende cAMP koncentrationer i cellen. Feed forward med F1,6BP er smart, da dette er produktet af forrige regulatoriske punkt i glykolysen og derfor kun sætter ekstra gang i gennemstrømningen mellem disse to punkter. Glukagon regulerer også dette punkt, da dette skal hæmmes ved faste.
I en situation med højt energi niveau er det vigtigt, at leveren fylder glykogen lagrene op. Insulin vil blive udskilt hvilket vil aktivere PKB igennem PI3K-pathwayen, som vil hæmme GSK3. Insulin vi også aktivere en anden pathway (MEK/MAP-pathwayen), som vil aktivere PP1, der vil defosforylere glykogen synthasen (aktiv), fosforylase kinasen (inaktiv) og fosforylasen (inaktiv). Når glucose koncentrationen i leveren stiger vil PP1 aktiveres idet glucose allosterisk tvinger GP over i T state hvorved GL-Cat (PP1) mister bindingsevne til GP og dissocierer, herefter dissocierer GL fra Cat og PP1 aktiveres.
Muskelarbejde
Musklerne aktiveres af det somatiske nervesystem fra hjernen, og acetyl cholin (ACh) bliver udsendt som neurotransmitter i synapse kløften. Herfra åbnes natrium kanaler, så der dannes en depolarisering over plasmamembranen, hvilket aktiverer spændingsafhængige calciumkanaler samt proteiner, der forbinder plasmemembranen med SR, hvor der også åbnes calcium kanaler. Ved øget koncentration af Ca2+ aktiveres GPK hvorved GP aktivers og derigennem øges glykogenolysen og glucose koncentrationen i musklen stiger hvilket er smart da glucose er lettilgængeligt energi for kontraktionen. Muskelkontraktion kræver meget energi derfor vil koncentrationen af AMP stige ved kontraktion hvilket aktivere glykolyse gennem aktivering af PFK1,
Der vil også udskilles adrenalin hvilket diffunderer fra binyren via blodet til musklerne, hvor 7TM receptoren (β-adrenerg) aktiveres og G-protein, adenylat cyklase, PKA aktiveres. PKA vil herefter aktivere glykogenolyse og derigennem glykolyse.
Man deler muskelarbejde op i aerobt og anaerobt. Dette er aktuelt, når man skelner mellem hårdt og mindre hårdt arbejde og manifesterer sig i, hvorvidt man er forpustet eller ej. Hvis man bliver forpustet, er det et tegn på, at blodet (og derved oxygen) ikke kan nå tilstrækkelig hurtigt ud til musklerne i forhold til hvor hurtigt energien bliver forbrugt under arbejdet. Dette har betydning for to ting: dels vil ikke alt glukose blive oxideret fuldstændigt, da NADH hober sig og der vil i stedet blive dannet laktat. Dels vil musklerne være mere afhængige af deres eget energilager (glukose, glykogen og fosfo-creatin), da substrater udefra ikke vil kunne nå ud via blodet. Under anaerobt arbejde kan cellen ikke danne ATP ud fra reduktionsækvivalenter (NADH og FADH2) idet der ikke er ilt tilstede til at aftage elektronerne, derfor vil ETC gå i stå. Stigende mængder af NADH vil hæmme glykolysen gennem hæmning af G3P DH, altså kan cellen ikke genere ATP. I stedet har musklen udviklet en gærings proces hvor pyruvate kan omdannes til laktat (mælkesyre) under forbrug af NADH. Denne proces sikre at NAD+ regenerer således at glykolysen fortsat kan køre selvom der ikke er ilt tilstede.
Under aerobe forhold, vil FA fra fedtvævet samt glukose dannet i leverens glukoneogenese være aktuelt og blive oxideret fuldstændigt i musklerne, da også ilt-mængden er tilstrækkelig.
Cori cyklus vil sørge for nydannelse af glukose ud fra laktat idet laktat sendes via blodet til leverens glukogenolyse, hvorfra det nydannede glukose sendes ud i blodet igen og typisk vil blive optaget af musklerne. Dette kan umiddelbart synes som en spild af energi da glukoneogenese jo koster 6ATP, mens man kun får 4 ATP ud fra glukose->laktat, men det er evolutionært fremmende i den aktuelle situation, hvor alt er indstillet på at bruge musklerne til fx at flygte eller løbe længere efter føde.
Under anaerobe forhold vil Cori cyklus først blive afsluttet efter arbejdet, da blodet først da vil kunne komme frem til leveren. Mennesket har kun en given mængde blod og det er ikke nok til at nå til både muskler og indre organer på samme tid. Derfor vil blodtilførsel til musklerne prioriteres højere end de indre organer.
Faste og regulering i leveren
Leverens vigtigste job i en faste situation er, at opretholde et konstant blodsukker. I leveren vil glukagon signalere faste ved at sætte sig i sin receptor, aktivere G-proteinet, der aktiverer adenylat cyklasen. Denne omdanner ATP til cAMP, der aktiverer PKA. PKA fosforylerer flere komponenter i cellen.
I glykogen metabolismen regulerer PKA phosphoryleringer først glykogen synthase (GS) hvorved denne inaktiveres og glykogenesen derfor hæmmes. Dette er en fordel for at undgå spildte cykler.
Udover regulering af glykogen syntesen gennem GS inaktivering, reguleres glykogen metabolisme også gennem aktivering af glykogen nedbrydning i en fastende lever celle. Aktiveret PKA vil også phosphorylere og dermed aktivere GPK (glykogen phosphorylase kinase) som aktiverer GP (glykogen phosphorylase) som katalyserer hydrolysen af glykogen til glukose-1P. Ved phosphorylering af GPK af PKA aktiveres kinasen delvist og kan phosphorylere GP hvormed enzymet skifter konformation fra inaktiv b-form til aktiv a-form. Aktivering af GP sikrer en effektiv aktivering af glykogen nedbrydning, hvormed glukose kan mobiliseres og i sidste ende medføre en stigning i blodsukkeret i hele kroppen.
En yderligere smart regulering af GP sker gennem glukose koncentrationen i cellen, for hvis der mobiliseres for meget glukose eller der indtages et måltid og koncentrationen derfor stiger i cellen, sker der en allosterisk hæmning af GP aktivitet ved at glukose direkte binder og hæmmer enzymet. Dette sikrer, at der ikke mobiliseres mere glukose end kroppen har brug for.
I en faste situation vil glukagon (fra alfa celler i pancreas) og adrenalin (fra binyren) begge signalere til leveren. Glukagon vil stimulere udskillelse af adrenalin under faste, så begge hormoner vil være til stede. Begge signalerer gennem en 7TM. Glukagon signalerer via en pathway til PKA, som vi vil se på nedenfor, mens adrenalin signalerer gennem en α1-adrenerg receptor med tilknyttet Gq protein, der igen aktiverer fosfolipase C (PLC). Dette enzym omdanner PIP2 i membranen til IP3 og DAG, hvoraf sidstnævnte diffunderer frit. IP3 sætter sig i en gate i en kanal i ER og gaten kan herefter åbnes, så Ca++ strømmer ud. Denne second messenger signalerer til glykogen fosforylase kinasen og aktiverer denne ved at sætte sig i delta subunitten, der består af calmodulin. Denne stigning i Ca2+ koncentration aktivere herved også CaMKII hvorved GS hæmmes, altså virker Ca2+ både som hæmmer af glykogen syntese men også som aktivator af glykogen nedbrydning. Der dannes herved glukose-1-P, der af fosfoglucomutasen omdannes til glukose-6-P.
Glykolysen/glukoneogenesen: Det første lag af regulering møder vi allerede i leverens glukose transporter (GLUT2) som i modsætningen til fx muskler og fedtvæv (GLUT4) har en langt højere KM værdi for glukose hvilket betyder at koncentrationen af glukose i blodet skal være meget høj før leveren begynder at optage glukose. Samtidig virker GLUT2 som udligner af glukose i lever og blod, så glukose i leveren vil frigives til blodet, når blodsukkeret er lavt. Dette sikrer at glukose kun metaboliseres i leveren når blodsukkeret er meget højt, derfor vil leverens optag af glukose i et faste stadie være meget lav.
Yderligere har leveren en modificeret udgave af hexokinasen (som katalyserer første trin i glykolysen), som hedder glucokinase. Denne kinase er speciel idet den har ca. 50 gang lavere affinitet overfor glukose, derfor skal der være meget høje koncentrationer tilstede inden de går videre gennem leverens glykolyse. Dette sikrer også at energi ikke bliver investeret med mindre glukose koncentrationen er høj, og derfor vil glukose i en faste situation ikke blive metaboliseret i leveren. Glucokinasen er yderligere reguleret ved at være tilbageholdt i kernen af en inhibitor når glukose ikke er til stede. Denne tilbageholdelse er aktiveret af F6P som er i direkte konkurrence med glukose om binding. Ved binding af glukose frigives inhibitoren og glucokinase aktiveres. Således forbruges den glukose, der frigives fra G-6-phosphatasen ikke i leveren, når der er lavt blodsukker.
Næste trin af regulering opstår i omdannelsen af Fruktose-6-P (F6P) til F1,6BP katalyseret af phosphofructokinase (PFK1) (den omvendte reaktion katalyseres af FBPase1 i glukoneogenesen). Begge enzymer, PFK1 og FBPase1, er reguleret af F2,6BP som dannes ud fra F6P katalyseret af PFK2 (den ene halvdel af det bifunktionelle enzym (DBE)). F2,6BP er en kraftig aktivator af PFK1 aktivitet i leverceller. Under faste vil DBE blive fosforyleret af PKA, og PFK2 hæmmes mens FBPase2 som deforsforylerer F2,6BP til F6P aktiveres. Hermed hæmmes glykolysen mens glukoneogenesen aktiveres.
Dette enzym er reguleret af PKA i lever specifikt da andre celle typer (muskler) indeholder en PFK2 som ikke har den inhibitoriske AA rest som PKA phosphorylere. Altså i en faste tilstand vil PFK2 overgå til FBPase2 hvormed F2,6BP falder og F1,6BP omdannes til F6P hvormed gluconeogenese aktiveres og glykolyse hæmmes.
Sidste reguleringstrin i glykolyse er omdannesle af PEP til pyruvat som er katalyseret af pyruvat kinase (PK). Dette trin er det sidste non-reversible trin i glykolysen og er derfor et vigtigt sted at regulere. Omdannelsen er reguleret af højt Acetyl CoA koncentration som fungerer som en allosterisk inhibitor sammen med NADH. Dette er smart idet højt Acetyl CoA signalerer, at der nok substrat til TCA eller højt niveau af beta-oxidation (faste), derfor skal leveren danne glukose. Altså vil høj koncentration af Acetyl CoA hæmme glykolyse og aktivere gluconeogenese. Dette er yderligere forstærket af at Acetyl CoA aktiverer Pyruvat Carboxylase (PC) som omdanner pyruvat til OAA, første step i glukoneogenesen. PK er yderligere allosterisk reguleret af ATP og alanin idet disse signalerer højt energi niveau og rigeligt substrat til dannelse af pyruvat gennem transaminering af alanin. Derudover hæmmer FA også direkte. Ud over allosterisk regulering af PK kan lever isozymet (L-PK) også reguleres covalent ved phosphorylering af PKA, hvilket hæmmer aktiviteten (dette sker ikke i muskler) denne phosphorylering fjernes igen af PP2A.
Når leveren er i faste vil energiniveauet være lavt derfor vil AMP, være højt og AMPK derfor være aktiveret. AMPK sammen med PKA vil hæmme omdannelsen af Acetyl CoA til MalonylCoA hvormed fedtsyre syntese hæmmes. Dette er igen smart da fedtsyre syntese er meget energikrævende og FA samtidigt oxideres i alle celler hvor det kan lade sig gøre. Dette sikrer kroppen mod energispild.
Glukagon udskilles fra alpha-cellerne i de Langerhanske øer i pancreas og leveren er det første organ, der oplever glukagon stimulering i port åre blodet. Dette resulterer også i, at koncentrationen her er højst og glukagon har derfor størst betydning for leveren.
Sidst men ikke mindst vil PKA og CaMKII tilgå kernen hvor de vil phosphorylere transkriptions-faktoren CREB (cAMP response element binding protein) hvorved den aktiveres og aktiverer transkription af glukoneogenetiske gener så som PEPCK .
Ved længerevarende faste (over et døgn) vil OAA fra TCA omdannes til glukose i leveren, hvilket betyder at Acetyl CoA fra beta-oxidationen ophobes i cellen, da dette ikke kan indgå i TCA og nedbrydes. Høje koncentrationer af Acetyl CoA vil betyde at KB syntese aktivers hvorved KB dannes og eksporteres til blodet.
Faste og regulering i musklerne
I en faste situation vil musklerne hovedsageligt forbruge FA. Dette sker automatisk som [FA] stiger. Forbrændingen af FA vil øge [NADH] og citrat og dermed sænke glykolysen og pyruvat dehydrogenasen, hvilket sænker glukoseforbrændingen.
Citrat vil hæmme PFK-1 og [G6P] vil stige. Dette vil hæmme hexokinasen. Husk, at det kun er isoformen af hexokinase i musklerne og ikke i leveren, der kan hæmmes af sit produkt. PFK2/FBPase2 i musklerne kan ikke fosforyleres og PFK-1 vil derfor blive reguleret allosterisk af citrat og AMP.
Glykogenesen vil være nedsat, grundet adrenalin i blodet, der vil hæmme glykogen synthasen igennem PKA fosforylering, samt glykogenolyse vil være delvist aktiv, da calcium ikke frigives medmindre der samtidig er muskelkontraktion (Ca++ frigivelse) og glykogen fosforylase kinasen kun delvist vil være aktiveret af PKA fosforylering.
Herudover vil PP1 være frigivet fra glykogen molekylet da GM vil være delvist PKA fosforyleret og derfor ikke kan associere PP1 med glykogen. Derudover vil en ligeledes PKA fosforyleret PP1-hæmmer sørge for at hæmme den nu frigivede PP1. Det er vigtigt at skelne imellem glykogens rolle i muskler og i lever: musklernes glykogen er hovedsageligt beregnet til ATP produktion under muskelarbejde, mens leverens glykogen er beregnet til blodglukose imellem måltiderne.
Sidst opdateret 31. maj 2023
