I denne artikel gennemgås et eksempel på hvordan man udfra en cDNA sekvens kan analysere og beskrive MTHFR defekt.
Abstract
Det kan være anvendeligt at analysere en bestemt sygdom udfra en sekvens fra et gen. Her vises hvordan man udfra en gensekvens analyserer hvilket humant gen det stammer fra og hvordan mutationer kan føre til sygdomme.
I dette eksempel ses på en mutation i genet for MTHFR der giver anledning til en stofskiftesygdom med forhøjet niveau af homocystein i blodet og for lavt methionin. Dette er en neurotoxisk tilstand, som kan give udviklingshæmning.
Baggrund
Hvis man har en del af en cDNA sekvens, kan man analysere hvilket gen det kommer fra og hvilken sygdom det er associeret med. I denne artikel tages udgangspunkt i nedenstående cDNA sekvens:
5’-GGAGACCCAATAGGTGACCAGTGGGAAGAGGAGGAGGGAGGCTTCAACTACGCAGTGGAC-3’
BLAST search er en søgemaskine der kan søge i gensekvenser og proteinsekvenser i en database. Man kan her søge på en bestemt nukleotid sekvens og BLAST search sammenligner så denne sekvens med sekvenser i databasen. Ved sammenligningen beregner BLAST en score og en Expect value (E value). Generelt stræber man efter at opnå en høj score og en lav E value.
Udfra BLAST søgningen blev følgende sekvens valgt: Homo sapiens methylenetetrahydrofolate reductase (NAD(P)H) (MTHFR), mRNA reference NM_005957.4[1] Dette resultat er altså MTHFR genet og har et match med den ønskede streng mellem bp 701-760 og der er et 100% match. Der er totalt 7150 bp. Genet findes på kromosom 1 på lokation p36, dvs. på den korte arm af kromosom 1 på lokation 36. Der er 12 exons i dette gen[2].
MTHFR
MTHFR genet koder for enzymet MTHFR. MTHFR står for Methylentetrahydrofolat reduktase, der er et enzym der katalyser omdannelsen af 5,10-methyleneTHF til 5-methylTHF. 5-methylTHF er vigtig, fordi den er methyldonor i omdannelsen af homocystein til methionin.
Methionin er en essentiel aminosyre, der i kroppen omdannes til homocystein – og tilbage igen til methionin. MTHFR er ansvarlig for gendannelsen af methionin i MTHFR kredsløbet. Dette kredsløb kaldes også for homocystein metabolismen.
Methionin kan omdannes til AdoMet som er en methyldonor i methyleringsreaktioner af f.eks. DNA.
MTHFR er en homodimer, hvor det katalytiske site på begge subunits sidder på N-terminalen. Her sidder aktive sites for substraterne NADPH og methyleneTHF.
Homocystinæmi og homocystinuri
Ved MTHFR defekter kan der ophobes homocystein både i blodet og urinen – en tilstand der kaldes henholdsvis homocystinæmi og homocystinuri. Homocystinæmi er associeret med øget risiko for atheroschlerose og blodpropper[3]. Under normale omstændigheder er der meget beskedne mængder homocystein i blodet, idet der er under 15 μM, men ved homocystinæmi kan niveauerne komme op over 50 μM[4].
Ætiologi
Homocystinæmi kan både forekomme ved defekter i MTHFR, men også ved andre mangler i homocystein metabolismen, som f.eks. mangel på folinsyre og vitamin B12. En anden arvelig tilstand kan være CBS mangel, hvor problemet er at homocystein ikke kan nedbrydes.[4].
MTHFR er en autosomal recessiv sygdom, hvilket betyder at hvis både mater og pater er bærer af genet er der 25% risiko for nedarvning af sygdommen. Det er den mest udbredte arvelige defekt i folat metabolismen[5].
Homocystein er neurotoxisk, fordi ophobning af dette fører til dannelsen af bl.a. AdoHcy, som er en inhibitor af methyleringsreaktioner. En ophobning af homocystein fører altså til at methyleringsreaktioner bliver hæmmet. Disse methyleringsreaktioner er essentielle for en normal udvikling af nervesystemet.
Homocystein dannes i alle væv, men nedbrydningen af det foregår kun i leveren og nyren. I andre væv er remethylering til methionin den eneste mulighed, hvilket gør at en defekt i denne fører til ophobning af homocystein i bl.a. nervesystemet[6].
Homocystein er reaktiv og kan omdannes til en række toksiske metabolitter, herunder Hcy-thiolacton. Denne metabolit har i forsøg med mus vist sig at kunne fremkalde anfald og ved højere doser død[6].
Symptomer
Ved medfødte MTHFR defekter ses hos barnet symptomer på neurologiske lidelser, pga. Manglende udvikling af hjernen, anfald, hydrocephalus og hæmmet udvikling[4].
Ved opvæksten og hos voksne kan ses der ligeledes psykiatriske lidelser, som f.eks. skizofreni, hjertekarsygdomme såsom slagtilfælde, atheroschlerose og blodpropper og andre neurologiske lidelser som cerebellar ataxi, anfald og hæmmet udvikling[4].
Diagnose & profylakse
Der anvendes ikke en egentlig screeningsmetode for MTHFR defekt, men måling af indholdet af methionin og homocystein i plasma fra nyfødte kan være en god test for sygdommen, med høj specificitet og sensitivitet[4]. Hvis man ser tidlige symptomer på MTHFR defekt, som f.eks. kardiovaskulære symptomer hos mindre børn, kan man måle niveauerne af disse, for at vurdere behovet for yderligere udredning.
Homocystein er en reaktiv aminosyre, som let omdannes til en lang række metabolitter, herunder Hcy-thiolacton, S-nitrosoHcy, Hcy-disulfider, homocysteinsyre og adenosylhomocystein (Ado-Hcy). Hcy-thiolacton kan måles ved HPLC og GC-MS og er muligvis derfor også en indikator på sygdommen[6].
Den primære forebyggelse af symptomer på MTHFR er at identificere og begynde behandling af sygdommen tidligt, for at undgå hjerneskade.
Behandling
MTHFR behandling går ud på at sænke mængderne af homocystein og hæve niveauet af methionin i blodet, så den neurologiske udvikling kan normaliseres. Da en del af den neurologiske udvikling sker i barndommen, er ønsket at diagnosticere sygdommen hurtigst muligt efter fødslen.
MTHFR defekter behandles ved tilskud af vitamin B12, folat, vitamin B6, betain og methionin[4].
Det kan være meget svært at styre niveauerne af homocystein og methionin, selv ved anvendelse af kosttilskud. Studier har vist at hvis man iværksætter behandling inden barnet er 15 dage gammelt, har behandlingen især succes i de første leveår. Iværksættes behandlingen sent eller hvis sygdommen ikke diagnosticeres, er behandlingseffekten meget lav. Dette understreger dog vigtigheden af tidlig diagnose[4].
Mutationer
I litteraturen er beskrevet forskellige mutationer der leder til MTHFR defekter, hvoraf de fleste er mutationer i et enkelt nukleotid (SNP mutationer)[5].
En af de mest beskrevet mutationer er c.677C>T (p.Ala222Val) der findes på exon 5 som forekommer imellem 24-44% af populationen. Denne mutation er beskrevet til at give fra mild til moderat homocystinæmi, især hvis indtaget af folat er lavt[5] [7].
En anden hyppig mutation er c.1298A>C (p.Glu429Ala) der findes på exon 8, som også giver en sænket aktivitet af MTHFR enzymet, men denne mutation er ikke så udførligt beskrevet i litteraturen endnu[7].
Studierne af hyppige mutationer viser, at disse mutationer oftest fører til en lavere affinitet mellem MTHFR og NADPH eller methyleneTHF – substraterne til MTHFR.
Restriktionsenzymer
Disse to mutationer er undersøgt på den sekvens der tidligere er fundet ved blast, ved at søge efter sekvensen bade med og uden sekvensen i NEBcutter[8]. Kun en del af sekvensen søges efter i NEBcutter, idet der er valgt +/- 7 omkring mutationen.
For at undersøge c.677C>T er bp 677 fundet og følgende sekvenser søges efter i NEBcutter:
gctgggcctgaagaa
gctgggcttgaagaa
Her ses resultatet for denne henholdsvis uden og med mutationen:
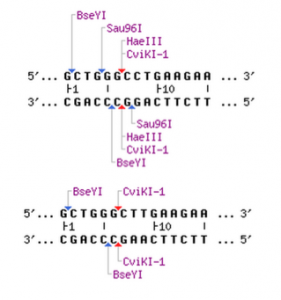
Her kan vi altså se at mutationen kan genkendes ved restriktionsenzymerne Sau96I og HaeIII. HaeIII har f.eks. genkendelsessekvens GGCC og det er netop det ene C der muteres og derfor kan restriktionsenzymet ikke længere anvendes på den muterede variant.
For at undersøge c.1298A>C er bp 1298 fundet og følgende sekvenser søges efter i NEBcutter:
ccccaagagccgaga
ccccaagcgccgaga
Resultatet i NEBcutter var her, at mutationen kan genkendes ved restriktionsenzymerne CviKI-1, HinP1I, HhaI og HaeII.
Summary
It can be convinient to analyze a certain disease from a sequence of a gene. Here is showed how to analyze which human gene a gene sequence comes from, and how mutations can lead to diseases.
In this example, we look on a mutation in the MTHFR gene that leads to a metabolism disorder with high levels of homocystein in blood and too low methionin. It is a neurotoxic condition that can lead to limited development of the brain.
Referencer
[3] http://www.omim.org/entry/603174?search=Homocysteinemia&highlight=homocysteinemia
[4] Manuel Schiff, Henk J. Blom: Treatment of Inherited Homocystinurias. Neuropediatrics 2012; 43(06): 295-304. DOI: 10.1055/s-0032-1329883.
[5] Burda, P., Schäfer, A., Suormala, T., Rummel, T., Bürer, C., Heuberger, D., Frapolli, M., Giunta, C., Sokolová, J., Vlášková, H., Kožich, V., Koch, H. G., Fowler, B., Froese, D. S. and Baumgartner, M. R. (2015), Insights into Severe 5,10-Methylenetetrahydrofolate Reductase Deficiency: Molecular Genetic and Enzymatic Characterization of 76 Patients. Human Mutation. doi:10.1002/humu.22779
[6] Asuri N. Prasad, Charles A. Rupar, Chitra Prasad, Methylenetetrahydrofolate reductase (MTHFR) deficiency and infantile epilepsy, Brain and Development, Volume 33, Issue 9, October 2011, Pages 758-769, http://dx.doi.org/10.1016/j.braindev.2011.05.014.
[7] Thierry Forges, Céline Chery, Sandra Audonnet, François Feillet, Jean-Louis Gueant, Life-threatening methylenetetrahydrofolate reductase (MTHFR) deficiency with extremely early onset: Characterization of two novel mutations in compound heterozygous patients, Molecular Genetics and Metabolism, Volume 100, Issue 2, June 2010, Pages 143-148, http://dx.doi.org/10.1016/j.ymgme.2010.03.002.
[8] http://nc2.neb.com/NEBcutter2/
Sidst opdateret 30. maj 2023
