Tilstand hvor det er længe siden en person har indtaget et måltid og sidste måltid er fuldt absorberet.
Man skelner mellem den postabsorptive fase som er kortvarig faste, f.eks. når man står op om morgenen og glukoneogenesisk fase der er ved langvarig faste, som begynder efter 1-2 dage uden mad fordi glykogenlagrene er tomme.
Faste er i længden farligt, dels fordi for meget ketogenese fører til en ketoacidose hvor pH i blodet bliver for lav og dels fordi der nedbrydes for meget protein fra muskler.
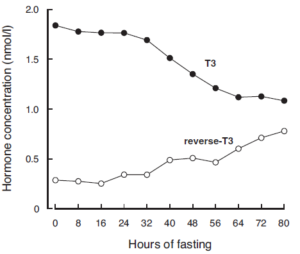
Ved længerevarende faste vil en faldende Leptinsekretion fra fedtvæv føre til at hypothalamus hæmmer TSH produktionen, så T3 niveauet falder. Det betyder at metabolismen nedsættes ved længerevarende faste.
Fysiologiske ændringer
Ved faste er kroppen i en lav energitilstand. Her vil følgende mekanismer blive påvirket af faste:
- Lipolysen aktiveres
- Et lavt glucoseniveau får pancreas til at secernere glukagon, som aktiverer lipaser og pirilipiner i adipocytter som henholdsvis katalyserer lipolyse og gør tilgængeligheden af TAG for lipaser større.
- Adrenalin stimulerer ligeledes også lipaser og pirilipiner i adipocytter.
- Det sympatiske nervesystem stimulerer også adipocytter til aktivering af lipaser og pirilipiner.
- Betaoxidationen aktiveres (foregår i mitekondrier og peroxisomer)
- Ved faste er insulinniveauet lavt, hvilket betyder en mindre aktivering af ACC og dermed en lavere konc. af MalonylCoA. Dette giver en mndre hæmning af Carnitin acyl transferase og betaoxidationen vil derfor forøges.
- Re-esterificering af FA til FA nedsættes – dog kun hvis FA niveauet ikke bliver for højt
- Dette skyldes at et lavt glucoseniveau også betyder et lavere niveau af glycerol-3-phosphat.
- Hvis der er for stort et niveau af FA i blodet, vil enzymet PEPCK-c dog stimulere til dannelse af glycerol-3-phosphat fra ikke-carbohydrate metabolitter.
- Glycerol fra lipolysen kan også i leveren omdannes til glycerol-3-phosphat.
- Lipogenesen bremses (foregår i cytosolen)
- Fedtsyresyntesen foregår ude i cytosolen udfra AcetylCoA, som findes inde i mitekondrierne. Transporten af AcetylCoA ud er afhængig af insulin, hvilket betyder at i en fastesituation vil dette formindskes, hvilket vil bremse Fedtsyresyntesen.
- Glukagon og adrenalin hæmmer citrats mulighed for at aktivere fedtsyresyntesen.
- Ketogenesen aktiveres (foregår i mitekondrierne i leveren)
- Ved lavt glucoseindtag skal der spares på glucose og derfor aktiveres ketogenesen, så FA omdannes til KB.
- Et højt AcetylCoA niveau fra betaoxidationen giver substrat til ketogenesen.
- Et højt niveau af AcetylCoA pga. en bremset TCA cyclus giver substrat til ketogenesen
- TCA cyclus bremses (foregår i mitekondrierne)
- OAA er optaget ved gluconeogenesen i stedet for TCA cyklus pga. højt glucagon niveau.
- Gluconeogenesen aktiveres (foregår i leveren)
- En lav B2,6BP konc. aktiverer gluconeogenesen. Glukagon sænker niveauet af B2,6BP.
- Glykogenolysen aktiveres (foregår i leveren og muskler)
- Glykolysen hæmmes
- Glukagon sænker koncentration af F2,6BP (fructose-2,6-bisphosphat) hvilket fører til en hæmning af glykolysen.
- Oxidation af FA vil danne en del NADH pg citrat der også bremser glykolysen
- [F6P]/[G6P] vil stige under oxidation af FA, hvilket vil hæmme hexokinasen, der fosforylerer og dermed determinerer glukosen til nedbrydning i cellen. Dette vil derfor ikke ske og glukosen blive i blodet (glukose-FA cyklus).
- Insulinniveauet afbalanceres
- FA og KB stimulerer til insulinproduktion, så niveauet ikke bliver for lavt.
- Ketoacidose, ved for store mængder af FA og KB
- FA og KB er syrer der sænker blodets pH. Sker som regel ikke ved raske mennesker, da FA og KB stimulerer til insulinsekretion.
- Proteinnedbrydning i muskler, bl.a. hjertemuskler
Sidst opdateret 31. maj 2023